国家药品监督管理局药品审评中心(CDE)日前发布《关于公开征求<化学仿制药参比制剂目录(第五十九批)>(征求意见稿)意见的通知》,新参比制剂纳入尚未发布品种69个、增补品种32个、未通过品种27个、再议品种目录2个。
值得关注的是,新增69个品规的参比名单中,包含国内上市的原研创新药物32个,其中出现了国产1类新药的身影,诸如贝达药业的埃克替尼,正大天晴的安罗替尼,丽珠集团的艾普拉唑,微芯生物的西达本胺,以及恒瑞的艾瑞昔布、阿帕替尼、吡咯替尼等在内的诸多重磅“明星”品种赫然在列。
审评审批制度改革以来,中国医药产业创新升级进入新阶段。相对过去的参比制剂目录多为海外跨国企业的原研品种,本次的征求意见稿公布在业内看来无疑有着特殊的意义。
业内人士指出,一大批本土医药企业中国原创新药涌现,极大改善了药物可及性,让患者得到了更多获益;另一方面,监管部门将这些中国原创新药纳入参比制剂,无异于广发“英雄帖”,伴随这些品种未来核心专利过期,势必吸引更多仿制药加入竞争,中国原创新药也势必面对“专利悬崖”带来的市场考验。
政策广发“英雄帖”
“专利悬崖”正在逼近
上世纪末本世纪初,我国医药产业高速发展,涌现出一批1类创新药和2类改良型新药。事实上,中国新药是中国医药产业发展的重要成果,为群众用药提供了便利和保障。
在鼓励创新药同时,仿制药研发同样是满足公众监管需求,改善药物负担的重要一环。根据《化学药品注册受理审查指南(试行)第一部分 注册分类1、2、5.1类》规定,我国的新药要成为参比制剂,应当“经国家药品监管部门评估确认”。
今年3月,两会期间,全国人大代表、华海药业总裁陈保华公开表示,应当加快修改完善现行有关政策,赋予中国新药参比制剂地位,为仿制中国新药创造前提条件,并鼓励仿制药上市,从而改变由于无法仿制导致一个品种长期独占市场的局面。
不难看出,对于中国原创新药的仿制工作,已经引起越来越多的行业关注,监管方面也给予了高度重视。相比起此前的参比制剂目录,本次发布的最新一批参比制剂目录,将中国原创新药列入参比制剂,有着非常鲜明的政策导向。
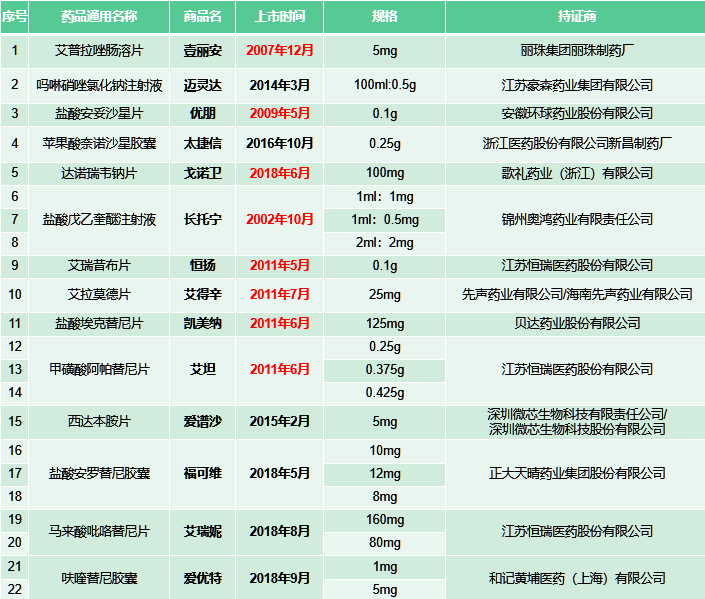
上述品种既有我国第一个具有自主知识产权的1.1类氟喹诺酮类抗菌药盐酸安妥沙星等“明星”品种,也有不乏年销售超十亿的大品种。以贝达药业的埃克替尼为例,在公司公布的2021年年报中,提及其销售额连续6年突破10亿元,毫无疑问的核心“现金流”品种;正大天晴的安罗替尼更是细分市场的头部品种,2020年销售额已经达到40亿元。
这一情况也与行业统计的销售数据吻合。米内网数据显示,2021年国产1类新药销售TOP20合计销售规模超过400亿元,其中有19个销售额达10亿元及以上(4款突破30亿元)。

值得关注的是,在上述中国原研新药中,上市时间较早的有锦州奥鸿药业的盐酸戊乙奎醚注射液,丽珠集团的艾普拉唑肠溶片,恒瑞医药的艾瑞昔布和甲磺酸阿帕替尼,贝达药业的埃克替尼,先声药业的艾拉莫德片等品种,部分产品的核心专利的保护期已经得到市场关注:
贝达药业在投资者平台上透露,埃克替尼的通式化合物专利将于2023年3月到期;不过,除通式化合物专利外,埃克替尼还受晶型、制备方法等多方面专利保护。
微芯生物在投资者互动平台表示,西达本胺的化合物专利到期时间是2023年7月;目前,西达本胺已在全球获得23项发明专利授权,构成了完善的专利保护网络,化合物专利到期后其他专利依旧能够对西达本胺形成良好的专利保护。
市场人士指出,据国家医保局在多轮集采中总结的经验,适合集采的品种要符合“临床使用量较大、采购金额较高、市场竞争较为充分”这三个条件,而在此前行业内部流出的未来五年内完成集采500个品种名单中,诸如埃克替尼、艾普拉唑、阿帕替尼、艾瑞昔布等核心专利即将过期的重磅大品种,已经得到了带量采购“关注”。
“以往提到‘专利悬崖’更多是针对跨国药企,品牌原研药过期之后由于仿制药在细分领域的价格竞争,将引发品牌药价格大幅下滑;如今中国原创新药被列为参比制剂,政策广发‘英雄帖’鼓励仿制,未来的‘专利悬崖’将不会只发生在进口药,中国原创新药也将面对竞争压力。”
高水平创新药仍具优势
专利攻防战悄然打响
事实上,医药产业对研发和专利保护具有高度的依赖性。我国自1993年1月1日起开始对化学领域发明的产品专利进行保护,原研新药将会有20年的专利保护期。在这期间,如果有其他企业进行仿制,将会付出高额代价。
今年6月1日,2020年新修订的《中华人民共和国专利法》正式施行。其中第四十二条明定了影响医药行业创新的关键内容:
为补偿新药上市审评审批占用的时间,对在中国获得上市许可的新药相关专利,国家专利行政部门应专利权人的请求给予专利权期限补偿,补偿期限不超过5年,新药批准上市后总有效专利权期限不超过14年。
一般而言,原研药具有疗效好、市场规模大、价格昂贵的特点。而原研药专利到期后,将会有质量与疗效一致,但价格大幅降低的仿制药上市。
设定专利保护期也是为了鼓励医药创新,因为原研药在研发阶段投入了大量的资金,因此需要一段时间的专利保护,使其能独享市场。为进一步提高药物可及性,改善医疗负担,国家鼓励药企在专利保护期过后对原研新药进行仿制,引入竞争,大幅度降低药价。
对于第一个冲进市场的仿制药,即首仿药,我国药改政策也给予了较大的鼓励。不仅在审评审批制度上给予方便,由国家药品监督管理局、国家知识产权局组织制定《药品专利纠纷早期解决机制实施办法(试行)》发布并施行,确定对于专利挑战成功的首仿药,将获得12个月的市场独占期。
业界认为,中国创新药在某些疾病领域相继出现从0到1的重大突破,完善相关法律法规志在保护有价值的创新,未来原创专利药获得保护期延长的加持,而创新水平不足的药品专利,即使获得了注册也无法起到护城河的作用,很有可能会被专利挑战所击退。
换而言之,药品专利“争夺战”已悄然打响,将赋予创新药与仿制药企业双向的机遇与挑战。专利挑战若能成功,将为国内企业的仿制药上市和正常销售扫清障碍。
以治疗类风关的JAK抑制剂托法替布为例。托法替布由辉瑞开发,正大天晴和齐鲁制药是国内开发托法替布仿制药速度最快的2家公司。2018-2019年,正大天晴和齐鲁制药对托法替布的2项关键专利(化合物和晶型专利)提出无效请求。原专利复审委员会分别于2018年8月对化合物专利、2019年11月对晶型专利作出“全部无效”决定。这提前为两家公司仿制药上市后的正常销售扫清专利障碍。
今年4月15日,北京知识产权法院公开宣判原告中外制药株式会社诉被告温州海鹤药业有限公司确认是否落入专利权保护范围纠纷一案,法院经审理认为,涉案仿制药并未落入涉案专利权的保护范围,判决驳回原告的诉讼请求。据悉,该案为新《专利法》实施以来全国首例药品专利链接诉讼案件,被行业视作“专利链接第一案”
行业普遍认为,专利挑战的高壁垒和知识产权的复杂性决定了挑战结果的不确定性。
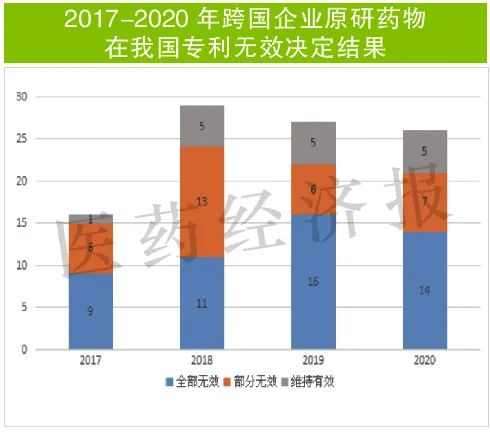
数据也印证了这一判断。国家知识产权局的专利无效宣告决定初步检索发现,2020年国家知识产权局公布的无效宣告决定号数量为26件,与此前两年(2018-2019)基本持平(分别为29件和27件),在近两年(2019-2020)的无效宣告决定中,全部无效决定都超过半数(分别为59%和54%)。
专家表示,创新药延长了五年专利窗口,不知能不能对冲带量采购、医保控费的影响,但可以肯定,没有真正意义的创新药物会越来越难过。只有创新药可利用专利期延长带来利润增长。
我国药品专利链接制度一方面是从鼓励药物创新的角度,授予创新药专利保护期延长以充分保护;同时,提高药品可及性的角度上,鼓励仿制药利用规则,通过专利挑战以及专利规避尽快合法地提前上市,目的是平衡创新药和仿制药的发展,以鼓励医药行业的创新发展。
参比制剂目录逐步更新,未来将有更多中国原创新药成为“参比制剂”,也将有更多1类、2类新药成为仿制药“围猎”的目标。面对医保谈判、带量采购等支付端的市场结构性变化,无论是创新药还是仿制药,产品市场生命周期管理如今已经成为决定产品成败的重要因素。



 渝公网安备 50023602000380号
渝公网安备 50023602000380号